2年生対象の環境分析化学実験で、今年はじめて呈色反応を用いたリン酸イオンの定量実験を担当しました。
リン酸イオンが水にどれだけ含まれているかは目で見ただけではわかりません。
ではどうしたら定量分析ができるか?
最低限理解しておいてほしいことは、サンプルに発色試薬を添加し、見たい物質との反応によって色のついている物質に変化させ、検量線によって標準液とサンプルの吸光度を比較してサンプルの濃度を決めるという方法 (比色分析 吸光光度法)、つまり、色の濃さで測る定量分析法があるということです。
以下、再提出者へのコメント
・テキストp8 実験の整理とまとめ方に従って作成してください。特に目的のない実験はやる意味がありません。
・学生番号は必ず記載をしてください。
・実験日、共同実験者を記載してください。
・実験方法はテキストを丸写しするのではなく、実際にやったことを記載してください。
(実験方法、結果については、実際にやったことなので、過去形で書くこと)
・空試料は何のために測定しますか?補正せずに検量線を引いている人が沢山います。
・物理学実験のテキストに最小二乗法というのがのっています。それを使って検量線の式を出してください。
+αで、レポートの中で各操作における反応を書けという課題がテキストにありました。
この課題、この実験の担当を初めてして思いましたが、正直、とっても難しい課題ですね。
学生さんのレポートでは、
ヘテロポリ化合物+塩化スズ → モリブデン青
このモリブデン青が青色を示すという答え方をしている学生が多く、中にはヘテロポリ化合物は、H3Mo12PO40であると書いてくださっている人もいましたが、モリブデン青については、どんなものなのか書いてくださっている学生は1人でした。【その1名は大変すばらしいと思います】きっと色々と調べてくださったのだと思いますが、モリブデン青って何?と疑問に思っても、どうやって調べてよいのかがわからない人が多かったのでないかと想像します。そこで、どうやって調べたら、調べたいことにたどり着くのか?せっかく大学で専門的なことを学習しているのですから、一般的には、こういうとき、どうやって調べたらよいかという点も含め、どんな反応が起きているのか記載しておきます。(モリブデン青、確かに分析化学の業界ではそう書かれてはいますが、なんだか、食用色素の青色1号みたいな名前で、分子の構造もわからず、せっかく大学にきて分子の構造や性質を学ぶのだから、もう少し深くつっこんでみよう)
1 教科書や指定の参考書(なければ図書館)を見る
学生実験というのは、研究と違って誰も知らないこと、わからないこと、答えがないことをしている実験ではないので、多くの場合で、教科書や参考書を調べれば、謎が解決することがあります。
今回は、以下の教科書、書籍を調べました。
(1) 第4版 実験化学講座15 分析 日本化学会編 丸善
P193 モリブデンブルー法について以下の掲載がありました。
ヘテロポリ酸イオンをL-アスコルビン酸で還元し、この還元生成物の吸光度を測定する。
(2) 定量分析の化学-基礎と応用- 朝倉書店
P195 実験方法の記載のみ
(3) 新分析化学実験 日本分析化学会北海道支部 編 化学同人
P189 似た実験でモリブデンイエロー法の記載ありだが、記載なし
(4) Advanced Inorganic Chemistry,Six Edition
P932 Heteropoly Buleとして少し記載あり。リン酸イオンの定量に関して記載なし
(5) CRC Handbook of Basic Tables for Chemical Analysis
P683 反応式として記載あり
分析化学の教科書と、無機化学の英語版の教科書の双方を調べると答えに行き着くわけですが(他の教科書には記載があるのかもしれませんが)、分析化学の観点からは、分析方法と分析の理論が重視され、無機化学の観点からは、分子構造や反応が重視されるため、分析化学と無機化学が繋がっているという認識がないと中々たどりつけないかと思います。また、洋書の専門書には書かれていましたが、図書館でどの本が該当するのかピンポイントで探すのは困難かもしれません。
ただし、教科書等は紙面のスペースが限られているので、省略していることが多く、知りたい情報に届かないときもあります。では、どうするかを次に述べます。
2 Web検索
(1) 日本語で検索
まず、日本語検索は情報量が少なく、専門的なことについて調べるには限界があり微妙です。特に、検索でよくでてくるWikipedia の記事は匿名で、一般的な記事については見る人が多いので、チェックしあって比較的正しい記述になることが多いのですが、専門的な学術のトピックは、見る人がほとんどいないため、最初に書かれた不正確な記事が訂正されずに残っていることがあります。また、記事の内容に責任を負う人がいないので、正確な情報源として捉え、利用することについては気をつけなければならないと感じています。
日本分析化学会の機関誌『ぶんせき』の記事を見ていただけると、過去に間違った情報もあったことがわかります。実際、「モリブデン青」「モリブデンブルー」のいずれで調べても、解答にはたどり着けませんでした。
また、Wikipediaよりも、日本語で得る学術情報 CiNii(サイニィ)というデーターベースを利用する方法もあります。詳細な説明はChemStationの記事で紹介されていますので、丸投げします。が、一言、「日本語で得る学術情報」というと、多くの学生さんが飛びついてきそうですが、英語で書かれた論文の方が情報量が圧倒的に多い気がします。実際に、モリブデンブルーの謎には辿りつけませんでした。
(2) 英語で検索
こういうときは、英語検索がオススメです。Sci Finderという学術論文雑誌検索エンジンもあるのですが、レポート関係で調べるならばGoogle Scholarを使うと家のパソコンでも検索できます。Google Scholarは、Google 社が無料で提供する学術論文検索用エンジンで「Molbudenium bule」で検索すると、色々な学術誌の情報がでてきます。検索結果にPDFへのリンクが貼られていれば、誰でも原著論文を読むことができます。
おそらく、モリブデンブルーの核心にせまる論文は以下の論文かと思います。
The molybdenum blue reaction for the determination of orthophosphate revisited: Opening the black box
Analytica Chimica Acta 2015, 890, 60-82.
残念ながら岡山大学では、Online Journalの契約の関係で、上記の論文はWebで閲覧できませんので、以下に入手した論文から内容を抜粋しておきますが、とても深い部分の情報まで知ることができました。
・Mo(IV)化学種
実は、MoO42– (pH=7)は、pHにより様々な化学種との平衡状態になっています。その数は条件によって23種類もあります。この実験では、pHが1付近になるような実験操作をしていますが、この条件では単一の化学種ではないので、単純にMoO42–として、次に化学反応式を考えることにします。
・酸とリン酸イオンを加えたときの反応
PO43– + 12MoO42– + 27H+ → H3PO4(MoO3)12 + 12H2O
ここで生成するH3PO4(MoO3)12は、中心にリン原子があるケージ型の錯体でとても面白い構造(論文参照)をしています。混ぜるだけの分析化学実験で、色の変化もなく、見た目も何も変わらないのに、このようなケージ型の構造の分子が組みあがっていると想像すると、とても面白いと思います。このケージ型の錯体には、αとβの異性体があります。通常、還元体においては、N2H6SO4で還元した場合、いくつかの還元種を経由して変化しますが、βの異性体の方が安定であるとのことです。
・SnCl2を用いた還元反応(モリブデンブルーとは)
実はSnCl2では、数種類の青色の化合物を経由して最終的に加熱や酸によって、βの還元体になることがわかります。
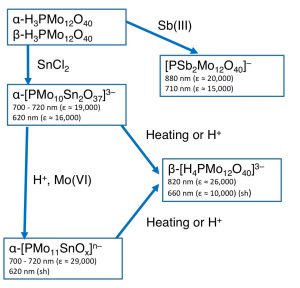
金属の価数変化がわかるように書いてみると4電子還元されていて
H3PMo(VI)12O40 → [H4PMo(VI)8Mo(V)4O40]3–と書けます。
分子構造はX線構造解析によって解明されています。J. Am. Chem. Soc. 1985, 107, 1771.
また、複雑なので、図には書き加えませんでしたが、N2H6SO4を還元剤とすると、2電子還元体が一旦生成し、そのスペクトルも測定され
ているのですが、これが不均化して、中性種を4電子還元体になるため、この図よりももう少し複雑になっています。
図を見るとわかりますが、SnCl2の場合は数種類の青色化学種を経由するので、少し面倒なことが起きていることがわかります。モリブデンブルーといっても1種類の物質ではないということです。
論文中で筆者らは、使用する還元剤としてアルコルビン酸とSb(III)を用いるとよいと述べています。これは、数時間は安定な還元生成物として[PSb2Mo12O40]–が数分以内に形成されるというためです。しかし、感度の高い分析が必要な場合は、SnCl2に共還元剤としてN2H6SO4を加えると、還元反応の速度が早くなり、生成するβ-[H4PMo12O40]3–
のモル吸光係数が[PSb2Mo12O40]–に比べ30%ほど高いとも述べています。ケースバイケースですね。